Буферные растворы − это растворы, сохраняющие неизменными значения рН при разбавлении или добавлении небольшого количества сильной кислоты или основания.
Протолитические буферные растворы представляют собой смеси электролитов, содержащие одноимённые ионы.
Существует два типа протолитических буферных растворов:
- Кислотные, состоящие из слабой кислоты и избытка сопряженного с ней основания (соли, образованной сильным основанием и анионом этой кислоты);
- Основные, состоящие из слабого основания и избытка сопряженной с ним кислоты (т.е. соли, образованной сильной кислотой и катионом этого основания).
Уравнение буферной системы рассчитывается по формуле Гендерсона-Гассельбаха:

где рК = -ℓg КД.
С – молярная или эквивалентная концентрация электролита (C = V N)
Механизм действия буферных растворов можно рассмотреть на примере ацетатного буфера: СН3СООН + СН3СООNa [1].
Высокая концентрация ацетат-ионов обусловлена полной диссоциацией сильного электролита – ацетата натрия, а уксусная кислота в присутствии одноименного аниона существует в растворе практически в неионизированном виде.
CH3COO‾ + H+ ↔ CH3COOH
Из уравнения видно, что сильная кислота НС1 заменяется эквивалентным количеством слабой кислоты СН3СООН. Количество СН3СООН увеличивается и по закону разбавления В. Оствальда степень диссоциации уменьшается. В результате этого концентрация ионов Н+ в буфере увеличивается, но очень незначительно, при этом рН сохраняется постоянным.
При добавлении кислоты к буферу рН определяется по формуле:
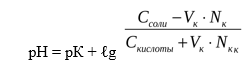
CH3COOН + OH ‾ ↔ CH3COO‾ + H2O
В результате этого щелочь заменяется эквивалентным количеством слабоосновной соли CH3COONa. Количество СН3СООН убывает и по закону разбавления В. Оствальда степень диссоциации увеличивается за счет потенциальной кислотности оставшихся недиссоциированных молекул СН3СООН. Следовательно, концентрация ионов Н+ практически не изменяется, и рН остаётся постоянным.
При добавлении щелочи рН определяется по формуле:
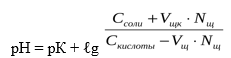
Таким образом, рН буфера зависит от константы диссоциации и соотношения концентрации компонентов. Чем эти величины больше, тем больше рН буфера. Стоит отметить, что рН буфера будет наибольшим при соотношении компонентов равным единице [2].
Буферная ёмкость − это способность буферной системы противодействовать изменению рН среды.
Буферная ёмкость (В) выражается количеством моль-эквивалентов сильной кислоты или щелочи, которое следует добавить к одному литру буфера, чтобы сместить рН на единицу.
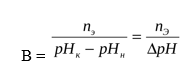
где В – буферная ёмкость, nЭ– количество моль-эквивалента сильной кислоты или щелочи, рНН – начальное значение рН ( до добавления кислоты или щелочи), рНК– конечное значение рН (после добавления кислоты или щелочи), ΔрН – изменение рН.
На практике буферная ёмкость рассчитывается по формуле:
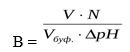
где V – объём кислоты или щелочи, N – эквивалентная концентрация кислоты или щелочи, Vбуф.- объём буферного раствора, Δ рН – изменение рН.
Буферная ёмкость зависит от концентрации электролитов и соотношения компонентов буфера. Наибольшей буферной ёмкостью обладают растворы с большей концентрацией компонентов и соотношением компонентов, равным единице [3].
В организме человека действуют следующие буферные системы:
- Бикарбонатный буфер, представляющий собой основную буферную систему плазмы крови; он является системой быстрого реагирования, так как продукт его взаимодействия с кислотами СО2– быстро выводится через легкие. Помимо плазмы, эта буферная система содержится в эритроцитах, интерстициальной жидкости, почечной ткани.
- Гемоглобиновый буфер является главной буферной системой эритроцитов, на долю которой приходится около 75% всей буферной ёмкости крови. Участие гемоглобина в регуляции рН крови связано с его ролью в транспорте кислорода и СО2. Гемоглобиновая буферная система крови играет значительную роль сразу в нескольких физиологических процессах: дыхании, транспорте кислорода в ткани и в поддержании постоянства рН внутри эритроцитов, а в конечном итоге – в крови.
- Фосфатный буфер содержится как в крови, так и в клеточной жидкости других тканей, особенно почек. В клетках он представлен солями К2НРО4и КН2РО4, а в плазме крови и в межклеточной жидкости Na2HPO4и NaH2PO4. Функционирует в основном в плазме и включает: дигидрофосфат ион Н2РО4-и гидрофосфат ион НРО42-.
- Белковый буфер состоит из белка-кислоты и его соли, образованной сильным основанием [4].
Белок – это амфотерный электролит и поэтому проявляет собственное буферное действие. Взаимодействие буферных систем в организме по стадиям:
Н++ НРО4-↔ Н2РО4-
СО2+ Н2О ↔ Н2СО3↔ Н++ НСО3-,
который нейтрализуется гидрофофат-ионами и аммиаком (аммиачный буфер):
H+ + NH3↔ NH4+
Следует отметить, что на поддержание постоянства рН различных жидких систем организма оказывают влияние не столько буферные системы, сколько функционирование ряда органов и систем: легких, почек, кишечника, кожи и др. [5].
pH крови человека в среднем составляет 7,4, изменение данного значения даже на одну десятую единицы приводит к тяжелым нарушениям (ацидоза или алкалоза). Когда водородный показатель выходит за пределы диапазона 6,8 - 7,8, это обычно ведет к гибели. Важнейшее буферная система крови — угольная (HCO3- / H2CO3), вторая по значению — фосфатный (HPO2-4 / H2PO-4), также определенную роль в поддержании pH играют белки [6].

 С.
М. Халикова
С.
М. Халикова