Аннотация: В исследовании сделана попытка смоделировать протекание реакции азоторганического соединения (на примере α-аланина) с простейшим кластером железа, и отождествить таковую реакцию с представлением об адсорбции азоторганического соединения на железе, что является ключом к пониманию антикоррозийной ингибиторной защиты. Рассмотрены изменения значения следующих квантово-химических дескрипторов: парциальных эффективных зарядов (Малликен), энергии граничных орбиталей.
Ключевые слова: ингибитор коррозии, aзоторганические соединения, изоэлектрическая точка ,HyperChem, полуэмпирические методы, ZINDO/1, физическая адсорбция, хемосорбция, комплексные соединения, энергия граничных орбиталей, парциальные эффективные заряды
Введение: Общей стадией механизма защитного антикоррозионного действия является адсорбция ингибирующих молекул на металле, которая зависит, прежде всего, от его электронной структуры, определяющей возможности хемосорбции на поверхностиметалла, а так же от заряда поверхности металла и частиц органического соединения, активных как ингибиторов коррозии.
Физическая адсорбция («электросорбция») является чисто кулоновским взаимодействием частицы органического соединения с поверхностью металла и часто сопровождается хемосорбционным взаимодействием и даже химическим изменением адсорбционных частиц. В случае сил физической адсорбции преобладают электростатические силы притяжения, особенно в начальный период адсорбционного взаимодействия[1].
Промежуточное положение между физическими и химическими (валентными) силами адсорбции занимает электронодонорное взаимодействие, связанное с переносом заряда (электронов) от донорного к акцепторному комплексу. Степень переноса может происходить до полного обобществления электронов. В качестве донора часто выступает молекула с неподеленной парой электронов, образуются π-связи, и с специфическими 3d-электронами – образуются σ-связи. Акцептор имеет дефицит электронов. Например, железо имеет незаполненную электронами 3d-оболочку, и способно обобществлять «свободные» электроны молекулы ингибитора. Таким образом, если при физической адсорбции лишь несколько смещаются электроны, то при химической имеет место полное обобществление электронов адсорбента твердым телом.
За адсорбционную связь «металл-ингибитор» несет "ответственность" реакционный (адсорбционно-активный) центр молекулы ингибитора. В органическом соединении он может быть представлен одним или несколькими атомами (гетероатомами, такими как кислород, азот, сера, селен), в которых имеются подвижные электронные пары, способные к донорно-акцепторному взаимодействию с поверхностью металла. Именно электронная плотность на адсорбционном центре ингибитора определяет прочность его связи, то есть его ингибирующий эффект. Она зависит от свойств заместителей, входящих в реакционный центр. При увеличении электронной плотности легче возникают хемосорбционные связи. Прочность связи металл-ингибитор увеличивается, если в его молекуле имеется несколько функциональных групп - центров адсорбций[2].
Методика проведения эксперимента: Для постановки эксперимента был использован простейший кластер, состоящий из 4 атомов железа. В водном растворе молекула α-аланина существует в виде следующих форм в зависимости от рН (рис. 1)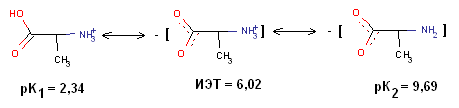
Рис. 1. Ионные формы 2-аминопропановой кислоты в водном растворе
Квантово-химический расчет (численный экссперимент) был проведен в программе HyperChem 8.0.9, силами ее собственных средств визуализации, при помощи полуэмпирического метода ZINDO/1 с предварительной оптимизацией во всех случаях также при помощи полуэмпирического метода ZINDO/1. В работе будут контролироваться значения следующих квантово-химических дескрипторов: парциальные эффективные заряды (Малликен), энергии граничных орбиталей[3].
Обсуждение результатов: Предварительно необходимо отметить некоторые допущения, примененные в данном исследовании. Во-первых, учитывались автором атомы железа, заряд которых около 0,1 по модулю, и образующие связь с формами молекулы аланина в диапазонах длин 2,05…2,70А, т.е. наиболее малых, которые проявились при выполнении численного эксперимента, поскольку можно было иметь уверенность, что силы адсорбции в их случае будут существенны. Во-вторых, пренебрежение гидратным окружением[4]. Изолированные формы молекулы будут иметь следующие контролируемые квантово-химические показатели (рис. 2)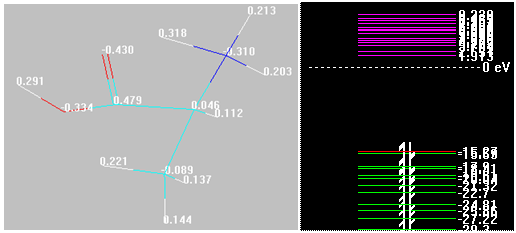
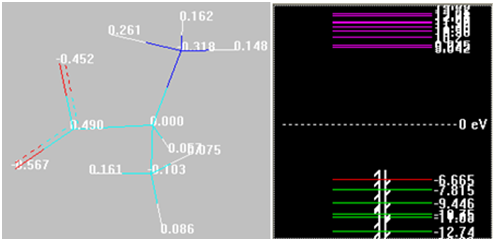
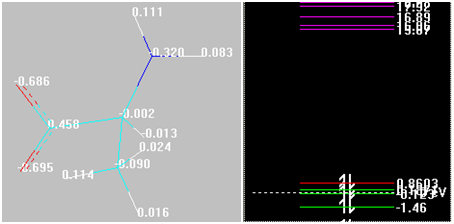
Полученные соединения можно отнести к комплексным, где реализуются донорно-акцепторные связи. Структуры и их парциальные эффективные заряды (Малликен), энергии граничных орбиталей будут следующие (см. рис. 3) 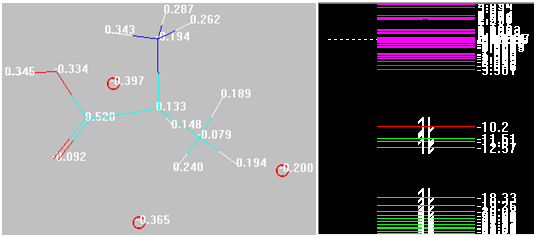
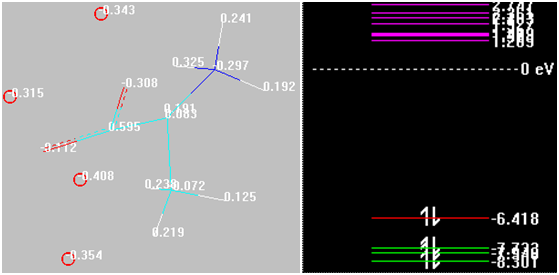
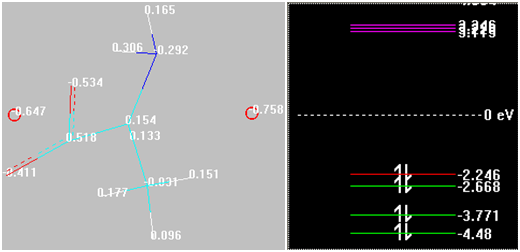
Рис. 3. Распределение малликеновских зарядов на атомах и энергии граничных орбиталей в представлении и оформлении HyperChem 8.0.9 конечных структур (трехмерное изображение)
Примечание Обозначения аналогичны таковым на рис. 2. Красными кружками обозначены атомы железа
Длины связей Fe—C.K. (где C.K. — структурные компоненты) (А) следующие (см. рис. 4)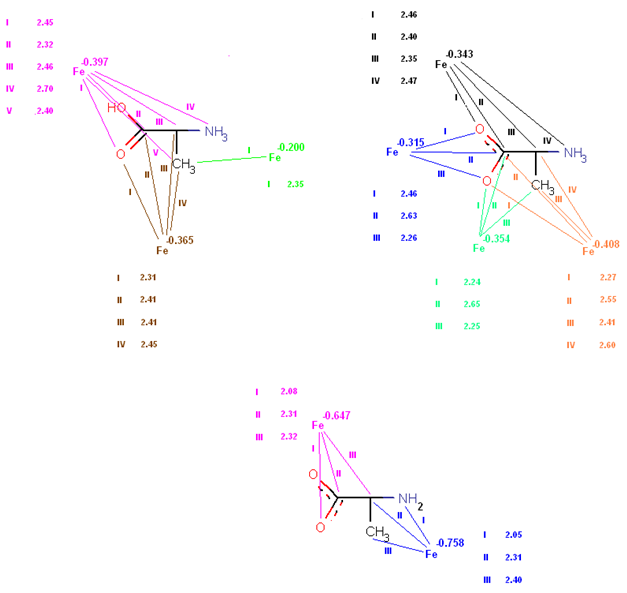
Рис. 4. Отображение образуемых донорно-акцепторных связей и их длин в ангстремах (двухмерное изображение)
Примечание Автор не ставил целью точное или масштабированное отображение длин связей Fe—C.K., а их возможное частичное или полное совпадение по масштабу является случайным
Очевидно, что различный состав получившихся комплексов объясняется силами физической адсорбции, которая наиболее резко проявляется, если структура несет на себе ярко выраженные катионные центры (протонированная аминогруппа, а также пониженный общий отрицательный заряд, что наблюдается при приближении к изоэлектрической точке). Гидроксид в кислотной группе не обладает склонностью донора, поскольку донирует электроны на карбонил кислотной группы. Атомы железа имеют координационные числа в диапазоне 3…5 . При переходе в щелочную среду координационное число, проявляемое каждым атомом железа, падает. Являются акцепторами (следовательно, они — комплексообразователи), что очевидно, поскольку они несут отрицательный заряд. Формы молекулы аланина обладают донорными свойствами, т.к. при взаимодействии с атомами железа происходит резкий отток заряда со С.К (это заметно также по повышению энергии ВЗМО, кроме формы при рН = 9,69, где взаимодействие с атомами железа снижает таковую; при переходе в щелочную среду валентные возможности 2-аминопропановой кислоты снижаются. Энергия НСМО также снижается во всех случаях). Фрагменты углеродного скелета «отвечают» скорее за электросорбцию, учитывая их пониженный заряд, гетероатомы — за явление хемосорбции. Метильная группа играет наибольшую роль при рН = 2,34, далее с повышением щелочности среды ее роль падает. Наибольший вклад в хемосорбцию вносят метильная и аминогруппа. Наибольший вклад в электросорбцию вносят фрагмент =СН—, а также карбоксильный углерод.
В структурах (см. рис. 4) реализуется равенство связей в случае связи атомов Fe с примерно равными по электроотрицательности С.К. Данная закономерность нарушается в «изоэлектрической» структуре (связь Fe —0.354 - =О) и в структуре при рН = 2,34 (такие связи, как Fe —0.397 - =О и Fe —0.397 - =СН—)
Вывод: Из представленной модели видно, что в сильнокислой среде образуется соединение состава Fe3C3H8NO2, в среде, близкой к нейтральной — соединение состава Fe4C3H7NO2, в сильнощелочной — соединение состава Fe2C3H6NO2. Поэтому можно утверждать, что самая сильная возможность к адсорбции на железе реализуется в ИЭТ, самая слабая — реализуется при рН более 7. Энергия ионизации в предположении теоремы Купманса с повышением рН падает (сродство к электрону возрастает, комплекс при рН = 2,34 имеет электрофильные свойства), поэтому, чем выше рН, тем большую склонность имеет комплекс к распаду в виде ионизации атомов железа: Fe – 2е = Fe2+ : в случае наличия щелочной среды железо будет разрушаться (корродировать).
Ссылки на источники
1. Тейлор Г. Основы органической химии. - М.: Мир, 1989. – С. 252-300.
2. Гоник А. А. Комплексная защита от коррозии нефтяных резервуаров по зонам агрессивного воздействия окружающей среды. // Практика противокоррозионной защиты. 2001. № 4(18). С. 48-57.
3. Сикачина А. А. Анализ строения азот- и фосфоразоторганических соединений по результатам полуэмпирических квантовохимических расчетов в сравнении с неэмпирическим [Текст] / А. А. Сикачина, С. М. Белоглазов // Технические науки: теория и практика: материалы II междунар. науч. конф. (г. Чита, январь 2014 г.). — Чита: Издательство Молодой ученый, 2014. — С. 102-106.
4. Сикачина А. А. Исследование зависимостей между защитным эффектом от коррозии и квантовохимическим дескриптором молекулярной структуры органических молекул класса комплексонов, использующихся как ингибиторы в средах микробиологической коррозии с участием сульфатредуцирующих бактерий [Текст] / А. А. Сикачина, С. М. Белоглазов // Технические науки: теория и практика: материалы II междунар. науч. конф. (г. Чита, январь 2014 г.). — Чита: Издательство Молодой ученый, 2014. — С. 98-102.
Quantochemical modelling of reaction of various forms 2-aminopropanic acid with iron atoms
Sikachina Andrey Anatolevich,
The post-graduate student of chemistry faculty of I.Kant Baltic Federal University
Abstract: In research attempt to simulate passing of reaction (on an example of 2-aminopropanic acids) with the iron cluster is made, and to identify that reaction with representation about adsorption nitroorganic substance on iron.That is a key to understanding of the corrosion-preventive inhibitor protection. Changes of value following quanto -chemical descriptors are examined: partial efficient charges by Mulliken, energy boundary of orbitals.
Keywords: inhibitor of corrosion, nitroorganic substance, an isoelectric point, HyperChem, semiempirical methods, ZINDO/1, physical adsorption, chemisorptions, complexes, energy boundary of orbitals, partial efficient charges.

 А.
А. Сикачина
А.
А. Сикачина