Методика проведения эксперимента: В рамках статьи исследовались гетерогенные системы открытого термодинамического типа«Ст3/дистиллированная вода» и «Ст3/NH4NO3, 30%».
Реализуемая технология проведения численного эксперимента описана в [2].
Данные по скорости коррозии, полученной по определенной методике, были взяты из [1, с. 48].
При задании исходной структуры, в файле-задании был учтен мезомерный эффект по структуре иона. В работе контролировались следующие дескрипторы электронной структуры: заряды на гетероатомах (by Mulliken) q, плотность заряда (на 1 атом железа) Feρq и состав получившихся соединений FexL, где L – неорганические ионы.
Результаты и обсуждение: В гетерогенной системе «Ст3/дистиллированная вода», имеющая рН = 5, часть молекул воды присутствует в форме гидроксониевых ионов, поэтому появляется адсорбционный комплекс состава Fe[H3O+] (треугольная структура) (Feρq = -0,081, поэтому вызываемая ионизация лимитируется лишь величиной рН) и адсорбционный комплекс состава Fe4[H2O] (Feρq = -0,120). Низкая скорость коррозии объясняется преобладающим присутствием последнего (тетраэдрической формы)[1] , что представлено на рис. 1[2]:

Рис. 1. Комплексы, порождаемые преобладающими в системе «Ст3/дистиллированная вода» ионами с обозначениями их парциальных эффективных зарядов
В гетерогенной системе «Ст3/NH4NO3, 30%», имеющая рН = 5 появляется адсорбционный комплекс состава Fe[H4N+][3] треугольной конфигурации (Feρq = -0.106, что говорит о прочности связи Fe-N и образовании пленок на металле), что представлено на рис. 2:
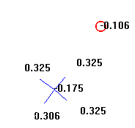
Рис. 2. Один из комплексов, порождаемый преобладающими в системе «Ст3/NH4NO3, 30%» ионами с обозначениями их парциальных эффективных зарядов
Также образуется адсорбционный комплекс состава Fe8[O3N—] (Feρq = -0.194), рассмотренный ниже.
При сравнении состава комплексов Fe8[O3N—] и Fe4[H2O] очевидно, что при однопорядковых величинах плотности заряда в комплексе Fe4[H2O] атомы железа получают большую электронную плотность, учитывая, что их четыре, чем в первом комплексе, несмотря на присутствие в таковом сильного отрицательного заряда.
Наиболее неоднозначная ситуация прослеживается с анионом нитрата NO3— , адсорбирующегося на стали по реакции (используемый на данном этапе кластер состоял из 8 атомов железа), что представлено на рис. 3:
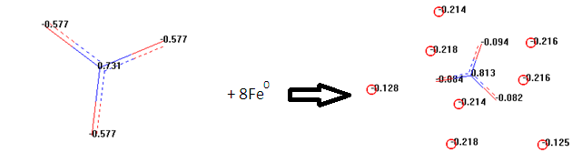
Рис. 3. Второй из комплексов (как конечный продукт), порождаемый преобладающими в системе «Ст3/NH4NO3, 30%» ионами с обозначениями их парциальных эффективных зарядов. Механизм его появления
Очевидно, что по модулю заряды на гетероатомах NO3— по модулю не очень отличаются, поэтому и окислительные свойства такового в растворе незначительны. Другое происходит с частицей ад-NO3— в составе Fe8[O3N—], где резко возрастают заряды атомов кислорода и азота. Адсорбируясь, нитрат-анион восстанавливается на катодных участках поверхности стали, с генерацией катионов из атомов железа (металла) в таковой, что представлено на рис. 4:
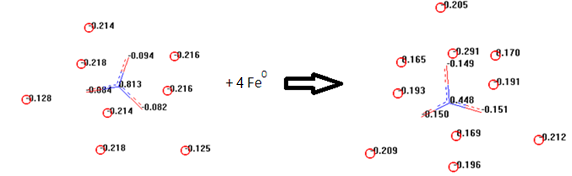
Рис. 4. Адсорбция Fe8[O3N—] на металлокластере, порождающая растворение стали
Происходит образование Fe10[O3N—] (Feρq = -0.099) с сильным понижением заряда центрального ионообразующего атома (процесс восстановления) и повышением заряда атомов кислорода. Катионы железа несут заряды порядка -0,16. Во-вторых, явно наличествует высокая плотность заряда на железе, что в [3, с. 49] является основополагающим в миссии защиты от коррозии. Следовательно, именно первое явление является в данном случае основополагающим.
Адсорбционный комплекс состава Fe10[O3N—] благодаря крайне низкому значению Feρqнеустойчив и ионизируется:
Fe10[O3N—] = Fe0.165 + Fe0.169 + Fe0.170 + Fe7[O3N—]
Плотность заряда в Fe7[O3N—] равна -0,214, т.е. резко повышается. Таким образом, с каждых 8 атомов железа, защищенных от окисления, 3 атома железа таковому подвергаются, а это основа коррозионного процесса.
Адсорбционный комплекс состава Fe[H4N+] является ингибирующим процесс растворения металла — более сильно ингибирующим, чем адсорбционный комплекс состава Fe[H3О+], что объясняется более высокой плотностью заряда на железе первого комплекса, тогда как второй имеет значительную тенденцию к распаду.
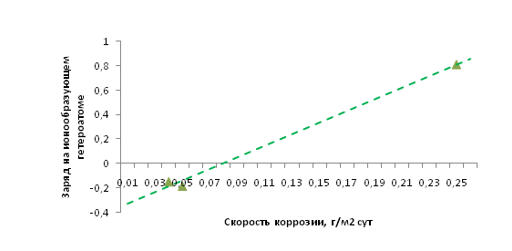
Рис. 5. Зависимость окислительных свойств нитрат-иона от скорости коррозии
Вывод: Согласно графической зависимости «скорость коррозии - заряд» изображенной на рис. 5, очевидно, что при повышении окислительных свойств аниона соли (повышении заряда центрального атома) скорость коррозии возрастает. Полное отсутствие коррозии (путем ингибирования) фиксируется при заряде центрального ионообразующего атома -0.400.
[1] Здесь и далее трехмерные изображения, генерируемые визуализатором HyperChem, естественно, показаны двухмерными. Автор не ставил целью точное двухмерное отображение масштаба конфигурации соединения, хотя, поскольку это скопированные в статью изображения, генерируемые визуализатором HyperChem, некоторая часть длин связей и углов подчиняется масштабу
[2] Красные углы – атомы кислорода, красные кружки – атомы железа, синие углы – атомы азота, белые концы – атомы водорода
[3] Наличие Fe4[H2O] принято незначительным вследствие эндотермической гидратации ионов соли. Также принято незначительным наличие Fe[H3O+], несмотря на наличие рН = 5, поскольку предварительные расчеты показывают (моль/л), что H4N+ : H3O+ = 5,1 ∙105 : 1.

 А.
А. Сикачина
А.
А. Сикачина