Предметные результаты на профильном уровне ориентированы на более глубокое освоение систематических знаний и способов действий, присущих данному предмету, и решить задачи освоения основ базовых наук, подготовки к последующему профессиональному образованию
Для облегчения усвоения учебного материала предлагаю большое количество схем и таблиц, выражающих или иллюстрирующих наиболее важные теоретические положения
При подготовке к ЕГЭ по химии задания уровня С выходят далеко за рамки двухчасовой школьной программы, например составление уравнений окислительно-восстановительных реакций или уравнений реакций по разрушению комплексных солей. Найти ответы на некоторые вопросы порой не удается ни в одном учебнике или пособии.
Одно из заданий высокого уровня сложности (уровня С) проверяет знания об амфотерных свойствах веществ. Для успешного выполнения этого задания нужно знать в том числе и способы разрушения комплексных солей. В учебной литературе этому вопросу уделяется мало внимания.
Амфотерные свойства имеют оксиды и гидроксиды многих металлов. Они не растворяются в воде, но растворяются в кислотах и щелочах. При подготовке к ЕГЭ нужно усвоить материал о свойствах соединений алюминия, цинка, бериллия, железа и хрома.
Основные свойства амфотерных соединений при взаимодействии с сильными кислотами
Например:
Zn O + 2HCI= Zn CI 2 + H2O ,
Zn(OH)2 +2HCI = ZnCI2 + 2H2O ,
AI2O3 +6HCI =2AICI3 + 3H2o ,
AI (OH)3 + 3HCI =AICI3 + 3H2O
Кислотные свойства при взаимодействии со щелочами
Реакции при сплавлении:
Формула гидроксида цинка записывают в кислотной форме - (цинковая кислота).
Кислотная форма гидроксида алюминия – (ортоалюминиевая кислота), но она неустойчива, и при нагревании отщепляется вода: получается метаалюминиевая кислота.
По этой причине при сплавлении соединений алюминия со щелочами получаются соли – метаалюминаты: Реакции в растворе происходят с образованием комплексных солей
Следует отметить, что при взаимодействии соединений алюминия со щелочами ( рН= 14) в растворе получаются разные формы комплексных солей ( к.ч.(АI) =6)
т.е. гексагидроксоалюминат натрия и тетрагидроксодиакваалюминат натрия
Соединения бериллия (ВеО и Ве(ОН)2) взаимодействуют со щелочами аналогично соединениям цинка, соединения хрома (III) и железа (III) (Cr2O3, Cr(OH)3, Fe2O3, Fe(OH)3) - аналогично соединениям алюминия, но оксиды этих металлов взаимодействуют только при сплавлении.
Cr2O3 + 2Na OH = 2NaCrO2 +H2O
метахромит натрия ( хромат(III) натрия)
Fe2O3 +2NaOH =2NaFeO2 +H2O.
феррит натрия (феррат (III) натрия)
При взаимодействии гидроксидов этих металлов со щелочами в растворе образуются комплексные соли с координационным числом 6.
Гидроксид хрома (III) легко растворяется в щелочах:
Гидроксид железа (III) имеет очень слабые амфотерные свойства взаимодействует только с горячими концентрированными растворами щелочей:
Способы разрушения гидроксокомплексов
1) При действии избытка сильной кислоты получаются две средних соли и вода:
2) При действии сильной кислоты ( в недостатке ) получаются средняя соль активного металла, амфотерный гидроксид и вода:
3)При действии слабой кислоты получается кислая соль активного металла , амфотерный гидроксид и вода:
4)При действии углекислого или сернистого газа получается кислая соль активного металла и амфотерный гидроксид:
Применение таблиц , схем на уроках химии:
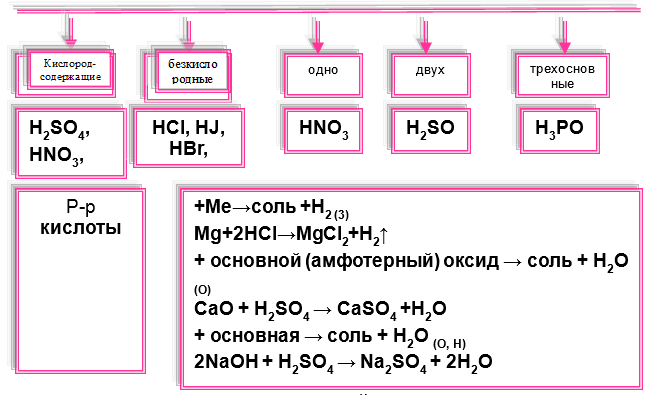
Химические свойства кислот
кислоты
Термическое разложение некоторых солей.
2KClO3 → 2KCl +3O2 ↑
2KMnO4 → K2MnO4 +MnO2 + O2 ↑
4KClO3 → 3KClO4 +KCl
4Na2SO3 → Na2S + Na2SO4
Оксиды. (не разлагаются все оксиды, кроме)
2HgO → 2Hg +O2
2PbO2 → 2Pb +O2
Кислоты. (не разлагаются все кислоты, кроме)
H2CO3 → H2O↑ + CO2↑
H2SiO3 → SiO2 + H2O↑
H2SO3 → H2O↑ + SO2↑
2HNO2 → NO↑ + NO2↑ + H2O↑
4HNO3 → 4NO2↑ + O2↑ + 2H2O
HCOOH→ CO↑ + H2O↑
H2C2O4 → HCOOH + CO2↑ 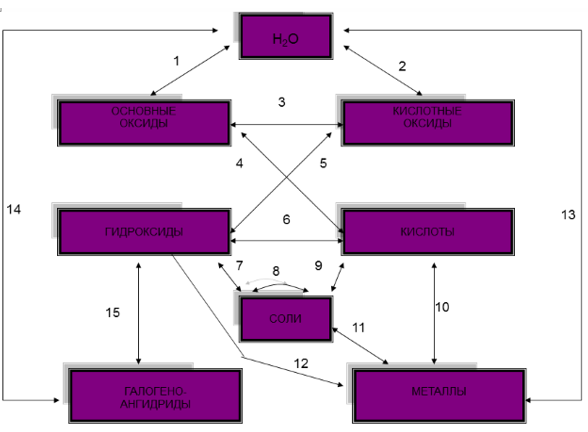
|
№ |
Продукты реакции |
Условия протекания |
|
1 |
Гидроксид |
Только для восьми оксидов: Li2O,Na2O,K2O,Rb2O,Cs2O, CaO,SrO,BaO |
|
2 |
Кислота |
Кислота, растворимая в воде |
|
3 |
Соль |
Ограничений нет (проблемы с растворимостью нет) |
|
4 |
Соль + H2O |
1)кислота, растворимая в воде 2)желательно, чтобы соль была растворима в воде |
|
5 |
Соль + H2O |
1)Гидроксид растворим в воде |
|
6 |
Соль + H2O |
1)Хотя бы одно из исходных веществ, растворима в воде |
|
7 |
Новая соль + новый гидроксид |
1)оба исходных соединений растворимы в воде 2)образуется газ, осадок,H2O,принцип Ле - Шателье |
|
8 |
соль + соль |
1)Также как и 7 |
|
9 |
Новая соль + новая кислота |
1)Исходная кислота растворима в воде (искл. H2SiO3) 2)Как правило, более сильная кислота вытесняет более слабую 3) принцип Ле - Шателье |
|
10 |
Соль + H2 |
1)кислота растворима в воде 2)Me активнее H2 3)факт ограничения: Me(Fe) →+2;HNO3;H2SO4(к) → H2 не выделяется |
|
11 |
Соль + Me |
1)Обе соли растворимы в воде 2)более акт. Ме вытесняет менее акт. Ме 3)примечания 8Me(5 щ. Me и 3щ. з. Me не брать, одновременно идет 13 |
|
12 |
Соль амфотерного гидроксида (гидроксокомплекс) и H2 |
1)Только для амфотерных металлов (Al,Cr,Zn,Be,Pb,Sn) |
|
13 |
гидроксид + H2 |
1)8 Me, т.е 5щ. и 3щ.з. Ме |
|
14 |
Смесь двух кислот + H2O |
SO2Cl2 + H2O → 2HCl + H2SO4 без ограничений сульфорилхлорид |
|
15 |
Две соли |
SO2Cl2 + 4KOH → K2SO4 + 2KCl + 2H2O |
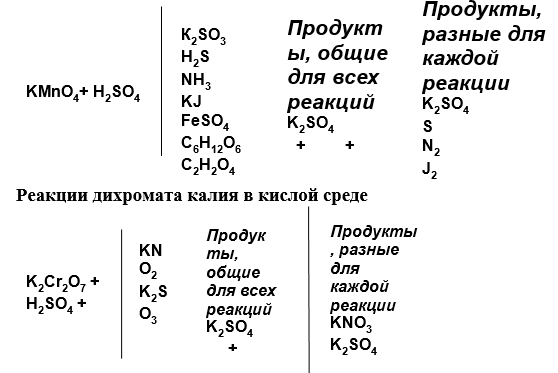
KMnO4 в среде H2SO4 реагирует с различными восстановителями.
окислитель
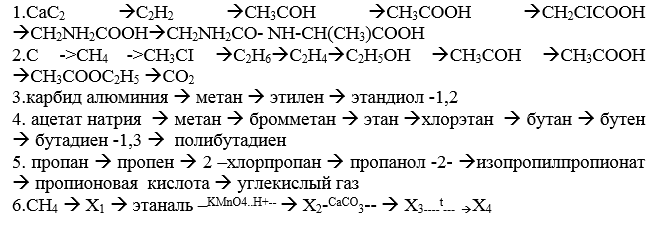
Важнейшая задача химии – получение веществ с заранее заданными свойствами и интенсификация промышленных производств, создание безотходных технологий. Материальный мир в котором мы живём и крохотной частицей которого мы являемся, един и в тоже время бесконечно разнообразен. Единство и многообразие химических веществ этого мира наиболее ярко проявляется в генетической связи веществ.
Для осуществления превращений необходимо знать: химические свойства классов органических веществ, способы их получения. Именные реакции, распознавательные (качественные реакции) на органические вещества - уметь составлять данные уравнения с различными гомологами в присутствии окислителей в различных средах (в нейтральной, кислой и щелочной) с использованием метода электронного баланса или метода полуреакций.
Генетическая связь между классами органических соединений (подготовка к ЕГЭ)
Решение задач – это практическое применение теоретического материала, приложение научных знаний на практике. Успешное решение задач учащимися поэтому является одним из завершающихся этапов в самом познании. Типовой программой определены требования к знаниям и умениям учащихся в части решения расчётных задач по органической химии: «Уметь находить молекулярную формулу по массовой доли элементов, по массе, объёму или количеству вещества –продуктов его сгорания, по химическим свойствам». Тогда целесообразно разделить этот тип задач на три раздела:
1.Углеводороды. Природные источники углеводородов и их переработка
2.Кислородсодержащие органические соединения.
3.Азотсодержащие органические соединения.
Учащихся лучше знакомить с несколькими способами определения МФ. С этой целью классную доску делим на две половины вертикальной чертой. На одной половине доски решаем задачу первым способом, на другой – вторым. Такая организация обучения даёт хорошие результаты (т.е. рекомендуем включать зрительную память)
Задачи на нахождение молекулярной формулы вещества(С-5)
1.Предельный одноатомный спирт сожгли. В результате реакции получили 22,4 л (н.у.) углекислого газа и 22,5 г водяных паров. Определите молекулярную формулу исходного спирта. (C4H9OH)
2.На полное сгорание 0,5 моль алкина израсходовано 28 л кислорода (н.у.). Установите молекулярную формулу алкина. (C2H2)
3.На окисление предельного одноатомного спирта пошло 10 г оксида меди (II). В результате реакции получили альдегид массой 10,75 г, медь и воду. Определите молекулярную формулу исходного спирта. (C5H11OH)
4. Предельный одноатомный спирт обработали металлическим натрием. В результате реакции получили вещество массой 20,5 г и выделился газ объёмом 2,8 л(н.у.). Определите молекулярную формулу исходного спирта. (C3H7OH)
5.Предельный одноатомный спирт нагрели до 170 – 1800С в присутствии концентрированной серной кислоты. В результате реакции получили газообразное вещество при н.у. с массовой долей водорода 14,29%и с относительной плотностью по гелию 10,5.
6.Определите молекулярную формулу исходного спирта. (C3H7OH) Установите молекулярную формулу предельной одноосновной кислоты, бариевая соль которой содержит 60,35% бария.
Использование расчётных задач в школе позволяет в значительной мере решать основные функции обучения и воспитания. Представленные материалы призваны оказать содействие в организации эффективной подготовки к экзамену. Они также могут использованы на уроках в целях повторения, систематизации и обобщения знаний. В этом пособии учащиеся найдут реальные задания, которые были представлены на ЕГЭ в предыдущие годы.

 Л.
Е. Сукнёва
Л.
Е. Сукнёва