Среди органических соединений встречаются вещества, способные вращать плоскость поляризации света. Данное явление называется оптической активностью, а соответствующие вещества - оптически активными. Оптически активные вещества встречаются в виде пар оптических антиподов, иными словами, изомеров или энантиомеров.
Оптические изомеры не отличаются друг от друга по таким показателям, как температура кипения, температура плавления, спектры ИК, УФ, ЯМР этих изомеров не отличаются друг от друга. Изомеры отличаются по биологическим свойствам и такому физическому свойству, как вращение плоскости поляризации плоскополяризованного света. Свет как электромагнитные колебания с определенной длиной волны представляет собой сумму векторов электромагнитных колебаний, двигающихся хаотично. После прохождения через некую среду, обладающую способностью поляризовать свет, на выходе будет получен свет с различным способом поляризации: циркулярно поляризованным светом по кругу, когда вектор электромагнитных колебаний совершает движение по кругу без изменения по абсолютной величине, при этом движение может совершаться по кругу влево (циркулярно поляризованный свет влево) или вправо (циркулярно поляризованный свет вправо).
Наложение двух циркулярно поляризованных источников с одинаковой интенсивностью влево и вправо дает плоскополяризованный свет (правило сложения векторов) [1].
Оптическая изомерия появляется тогда, когда в молекуле присутствует асимметрический атом углерода. Так называют атом углерода в sр3- гибридизации и связанный с четырьмя различными заместителями. Возможны два тетраэдрических расположения заместителей вокруг асимметрического атома. Стоит отметить, что две пространственные формы нельзя совместить никаким вращением; одна из них является зеркальным изображением другой (рис. 1).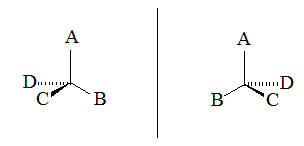
Рис. 1. Изображение оптической изомерии
Асимметричными могут быть и другие атомы, например азота, серы, фосфора. Соединения с одним асимметричным атомом углерода существуют в виде двух изомеров, соотносящихся как предмет к своему зеркальному отражению, правовращающих -D и левовращающих -L изомеров [2].
В настоящее время существует и другая, так называемая R,S-номенклатура оптических изомеров (от rectus – правый и sinister – левый) по проекции Фишера, в которой младший заместитель (обычно атом Н) расположен на одной из горизонтальных связей. В этом случае не проводят указанных выше перестановок, а сразу определяют старшинство заместителей. Однако, поскольку атом Н находится «не на месте» (что равносильно противоположной конфигурации), падение старшинства будет означать теперь не R-, а S-конфигурацию [3].
Хиральность молекул была открыта Л. Пастером в 1848 году. Пастер обратил внимание на то, что кристаллы, выпадающие из раствора рацемического тартрата натрия-аммония, имеют две формы, представляющие собой зеркальные отражения, которые не совмещаются друг с другом в пространстве (рис. 2). Напротив, кристаллы индивидуального правовращающего тартрата натрия-аммония имели одинаковую форму с малыми плоскостями, направленными в одну сторону. Пастер провёл подобные кристаллизации с тринадцатью энантиомерно чистыми соединениями (различными тартратами и винной кислотой), а также с шестью рацемическими тартратами и сделал вывод о существовании хиральности молекул, и объяснил ранее неизвестный вид изомерии винных кислот – энантиомерию [4].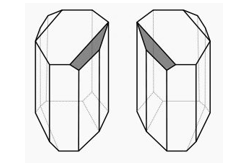
Рис. 2. Энантиоморфные кристаллы правовращающего и левовращающего тартратов
Отличительная особенность всех живых организмов состоит в том, что органические соединения, из которых они построены, представлены одним из возможных оптически активных стереоизомеров. Например, за исключением глицина, самой простой аминокислоты, не обладающей оптической активностью, все аминокислоты, входящие в состав природных белков, состоят из L- сахара, образующие полисахариды D-форм. В то же время при синтезе органических веществ в лабораторных условиях всегда получается равномерная смесь обеих форм стереоизомеров, называемая рацемической смесью. В этом проявляется принципиальное различие между синтезами органических веществ, происходящими в живой клетке и в лабораторных условиях. В первом случае продукт биосинтетической реакции представляет собой вещество в определенной оптической форме, во втором - продуктом реакции является смесь обеих оптических форм синтезированного вещества.
В настоящее время известно, что все белки на нашей планете построены только из левовращающих аминокислот, а нуклеиновые кислоты - из правовращающих сахаров; это свойство, называется хиральной чистотой. Она считается одной из фундаментальнейших характеристик живого. Так как при любом абиогенном синтезе (например, в аппарате Миллера) образующиеся аминокислоты будут состоять из приблизительно равных (по теории вероятностей) долей право- и левовращающих изомеров, то в дальнейшем - при синтезе из этого "сырья" белков - перед учеными встанет задача: разделение смеси веществ химическими методами, которые по определению химически идентичны. Стоит отметить, что оптической активностью обладают лишь природные сахара - и ни один из синтетических, а полипептиды из метеоритного вещества состоят из равных долей право- и левовращающих аминокислот [5].

 Ю.
Н. Никитина
Ю.
Н. Никитина