Список принятых авторских сокращений
К – скорость коррозионного процесса, выражаемая в г / м2 ∙ сут
qS– заряд на атоме серы сульфамидной группы
1qО - наименьший заряд на атоме кислорода сульфамидной группы
2qО - наибольший заряд на атоме кислорода сульфамидной группы
саqN- заряд на атоме азота сульфамидной группы
бqN– заряд на атоме азота аминогруппы, связанной с бензольным кольцом
qС=О –заряд на атоме кислорода кетогруппы
ппqN– заряд на атоме азота, являющемся составной частью амидной группы
кqС – заряд на углероде карбоксильной группы
э1qО- наименьший заряд на атоме кислорода группы простого эфира
э2qО - наибольший заряд на атоме кислорода группы простого эфира
Feρq-заряд, приходящийся на один атом железа (плотность заряда)
Цель исследования: В данном сообщении ставится цель исследования механизма действия органических ингибиторов микробиологической коррозии, порождаемой сульфатвосстанавливающими бактериями, путем квантово-химического подхода к описанию структуры молекулы.
Материал и методы исследования: Данные по скорости коррозии были взяты из [2, с. 11] для 7 представителей класса сульфаниламидов, выступающих как ингибиторы сероводородной коррозии, добавленные в концентрации 1, 2, 10 мМоль/л в содержащуюся в закрытой системе (пробирка) жидкую стерильную обескислороженную среду Постгейта «Б» (рис. 1):
Определение проводилось при помощи программного комплекса HyperChem 8.0.7.Нахождение величин квантовохимических дескрипторов проводилось в 2 этапа: путем оптимизации геометрии методом молекулярной механики: сначала ММ+, а затем OPLS. Собственно расчет проводился в рамках полуэмпирического ZINDO/1 [3, с. 5]. При задании исходной структуры, в файле-задании был учтен мезомерный эффект по цепи ОС.
Результаты исследования и их обсуждение: Сгенерированные результаты сведены в таблицу 1
Таблица 1. Значения вычисленных квантовохимических дескрипторов молекул сульфаниламидов и комплексных соединений на их основе
|
Коды соединений |
ОС1 |
ОС2 |
ОС3 |
ОС4 |
ОС5 |
ОС6 |
ОС7 |
|
|
ЕВЗМО |
-9,334 |
-8,185 |
-7,758 |
-1,871 |
-7,622 |
-4,076 |
-0,164 |
|
|
ЕНСМО |
5,990 |
4,980 |
5,844 |
10,525 |
5,627 |
5,172 |
10,745 |
|
|
ΔЕ |
15,324 |
13,165 |
13,602 |
12,396 |
13,249 |
9,248 |
10,909 |
|
|
Парциальные эффективные заряды на атомах |
qS = 0,560 |
бqN = -0,336 |
бqN=-0,338 |
бqN= -0,344 |
бqN = -0,339 |
кqС = 0,308 |
саqN = -0,427 |
|
|
1qО= -0,408 |
qS= 0,579 |
qS=0,534 |
qS= 0,477 |
qS = 0,539 |
qС=О= -0,145 |
qS = 0,473 |
|
|
|
2qО = -0,419 |
саqN= -0,279 |
1qО=-0,419 |
1qО= -0,480 |
1qО = -0,419 |
ппqN= -0,238 |
1qО = -0,476 |
|
|
|
саqN= -0,306 |
qС=О = -0,479 |
2qО=-0,431 |
2qО= -0,481 |
2qО= -0,413 |
qS= 0,548 |
2qО= -0,475 |
|
|
|
|
1qО =-0,405 |
саqN=-0,234 |
саqN= -0,420 |
саqN = -0,234 |
1qО= -0,415 |
бqN= -0,345 |
|
|
|
|
2qО=-0,408 |
|
qС=О = -0,554 |
э1qО = -0,258 |
2qО= -0,420 |
|
|
|
|
|
ппqN=-0,463 |
|
|
э2qО = -0,262 |
саqN= -0,224 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Состав комплексов |
Fe12[OС1] |
Fe13[OС2] |
Fe16[OС3] |
Na+Fe18[OС4]— |
Fe21[OС5] |
Fe19[OС6] |
Na+Fe20[OС7]— |
|
|
ЕВЗМО |
-7,865 |
-8,361 |
-7,987 |
-4,897 |
-8,171 |
-7,904 |
-5,120 |
|
|
ЕНСМО |
-2,244 |
-2,794 |
-2,974 |
0,482 |
-3,225 |
-1,805 |
0,993 |
|
|
ΔЕ |
5,621 |
5,567 |
5,013 |
5,379 |
4,946 |
6,099 |
6,113 |
|
|
Парциальные эффективные заряды на атомах |
qS = 0,766 |
бqN = -0,140 |
бqN=-0,136 |
бqN= -0,109 |
бqN = -0,092 |
кqС = 0,588 |
саqN = -0,038 |
|
|
1qО= -0,029 |
qS= 0,824 |
qS=0,785 |
qS= 0,782 |
qS = 0,750 |
qС=О= -0,029 |
qS = 0,800 |
|
|
|
2qО = -0,036 |
саqN= -0,109 |
1qО=-0,040 |
1qО= -0,033 |
1qО = -0,035 |
ппqN= -0,127 |
1qО = -0,035 |
|
|
|
саqN= -0,111 |
qС=О = -0,055 |
2qО=-0,069 |
2qО= -0,020 |
2qО= -0,047 |
qS=0,765 |
2qО= -0,033 |
|
|
|
|
1qО =-0,072 |
саqN=-0,076 |
саqN= -0,028 |
саqN = -0,039 |
1qО=-0,015 |
бqN= -0,133 |
|
|
|
|
2qО=-0,068 |
|
qС=О = -0,083 |
э1qО = -0,029 |
2qО=-0,057 |
|
|
|
|
|
ппqN=-0,166 |
|
|
э2qО = -0,112 |
саqN=-0,034 |
|
|
|
|
Feρq
|
-0,296 |
-0,379 |
-0,397 |
-0,337 |
-0,351 |
-0,445 |
-0,398 |
|
Зависимость скорости коррозии в концентрации ингибитора 1, 2, 10 мМоль/л от плотности заряда на железе выражается графически (с использованием линейных линий тренда) следующим образом (рис. 1):
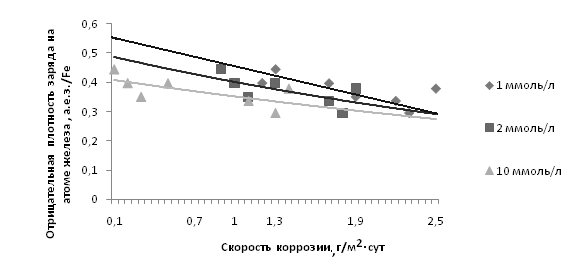
Рис. 1. Зависимость скорости коррозии от плотности заряда на железе
Практическая значимость публикуемой работы такова, что графическая зависимость, изображенная на рисунке 1, в пределах более-менее структурно модифицированных ОС данного класса является справедливой, в связи с чем в целях экспрессного подхода возможно применять уравнения заданных линий тренда с угловым коэффициентом, выраженные для исследуемых концентраций:
Таблица 2. Уравнения заданных линий тренда, выраженные для исследуемых концентраций
|
Концентрация ОС |
Характеристическое уравнение |
|
1 ммоль / л |
Feρq= 0,11К — 0,56 |
|
2 ммоль / л |
Feρq= 0,08К — 0,48 |
|
10 ммоль / л |
Feρq= 0,04К — 0,39 |
Очевидно, что в концентрации 1 мМоль/л такая зависимость наиболее сильна, т.е. на более резкое увеличение плотности заряда на железе приходится более резкое уменьшение скорости коррозии. При концентрациях выше такая зависимость сохраняется, но выражается менее резко. При скорости коррозии 2,5 г/м2∙сут зависимость скорости коррозии от зарядовой плотности на железе теряется, последняя принимает стабильное значение Feρq= - 0,300.

 Andrei Sikachina
Andrei Sikachina